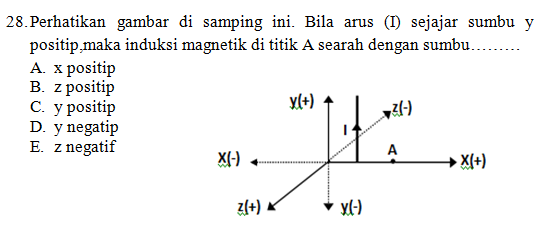
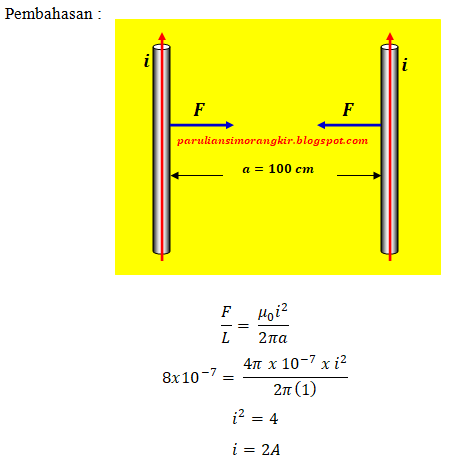
dilengkapi dengan pembahasan
01. Kelemahan teori atom Dalton adalah tidak
menjelaskan...
A. Atom memiliki inti dan elektron
B. Atorm dari unsur sejenis memiliki sifat yang berbeda
C. Atom-atom gas tidak dapat bergabung
D. Atom tidak bisa dibagi-bagi
E. Atom dapat bergabung membentuk molekul
(UN 2013)
Pembahasan:
Model atom Dalton tidak menjelaskan tentang inti dan elektron.
Jawaban: A
02.
Kelemahan teori atom
Rutherford adalah...
B. Elektron menyebar merata dipermukaan bola atom.
C. Elektron berputar mengelilingi inti seperti tata surya.
D. Elektron mengelilingi inti memancarkan gelombang elektromagnetik.
E. Atom terdiri dari muatan positif dan muatan negatif.
(UN 2013)
Pembahasan:
Salah satu kelemahan atom Rutherford adalah tidak bisa menjelaskan
kestabilan atom yaitu elektron memancarkan gelombang elektromagnetik ketika
mengitari inti.
Jawaban: D
03. Manakah pernyataan berikut
ini yang merupakan kelemahan teori atom Bohr?
A. Tidak dapat menjelaskan efek Zeeman.
B. Tidak dapat menjelaskan gaya sentripetal
elektron.
C. Bertentangan dengan fisika klasik.
D. Bertentangan dengan teori Dalton.
E. Tidak dapat menentukan energi transisi.
(UN 2013)
Pembahasan:
Kelemahan model atom Bohr adalah tidak dapat menjelaskan spektrum
warna atom berelektron banyak.
Jawaban: A
04.
Salah satu
pernyataan tentang model atom Thomson adalah...
B. Elektron berkumpul membentuk inti atom.
C. Atom merupakan bagian terkecil.
D. Atom memiliki muatan (+) dan (–) yang tersebar merata.
E. Elektron berada disekitar inti atoam.
(UN 2013)
Jawaban: D
05.
Perbedaan
utama antara model atom Rutherford dan model atom Bohr adalah....
A. Elektron berputar mengelilingi inti dengan membebaskan
sejumlah energi.
B. Elektron merupakan bagian atom yang bermuatan
negatif.
C. Atom berbentuk bola kosong dengan inti berada
di tengah.
D. Secara keseluruhan atom bersifat netral.
E. Massa atom terpusat pada inti atom.
(UN 2009)
Pembahasan:
Atom Rutherford menjelaskan elektron melepas energi ketika
mengitari inti sedang Bohr menjelaskan elektron tidak memancarkan/menyerap
energi ketika mengitari inti.
Jawaban: A
(UN 2010)
06. Perhatikan pernyataan-pernyataan berikut:
1. Atom terdiri dari elektron yang bermuatan
negatif dan inti atom yang bermuatan positif.
2. Elektron mengorbit inti atom seperti planet
mengorbit matahari.
3. Elektron mengorbit inti atom pada orbit yang
stasioner tanpa memancarkan energi.
A. (1), (2), dan (3)
B. (1) saja
C. (2) saja
D. (3) saja
E. (1) dan (3) saja
Pembahasan:
Yang membedakan atom Thomson dengan atom
Rutherford adalah no. 1 saja sedangkan no. 2 dan 3 adalah kesamaan dan
perbedaan atom Rutherford dengan atom Bohr.
Jawaban: B
(UN 2013)
model atom Thompson adalah...
A. Sebagian partikel alfa melewati lempeng emas tanpa mengalami pembelokan
Kelemahan atom Thompson adalah tidak dapat menjelaskan susunan muatan positif dan negatif yang tersebar merata.
(UN 2009)
Energi elektron pada orbit dengan bilangan kuantum n = 4 adalah....
B. 1,24 eV
C. 0,96 eV
D. 0,85 eV
E. 0,76 eV
(UN 2010)
hidrogen adalah En = 13,6/n2 maka, sebuah elektron yang tereksitasi
dari lintasan n = 1 ke n = 4 mengalami perubahan energi elektron
sebesar....
A. 12,75 eV
(UN 2010)
10. Dalam model atom Bohr, ketika elektron atom hidrogen
berpindah dari
orbit dengan
bilangan kuantum n = 1, ke n = 3, maka elektron tersebut
akan....(En = − 13,6/n2 ).
A. menyerap energi sebesar 1,50 eV
B. memancarkan energi sebesar 1,50 eV
C. menyerap energi sebesar 2,35 eV
D. memancarkan energi sebesar 12,09 eV
E. menyerap energi sebesar 12,09 eV
Pembahasan
Diketahui:
n1 = 1
n2 = 3
Ditanya: ΔE
Jawab:
ΔE = - 13,6 eV (1/n2 - 1/n1)
ΔE = - 13,6 eV (- 0,888) = 12,09 eV
Jawaban : E