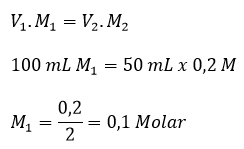Suatu suku banyak f(x), jika dibagi (x – 2)
sisanya 5 dan dibagi (x + 3) sisanya – 10.
Jika dibagi (x2 + x – 6) sisanya adalah …
A. – 3x + 11
B. 3x – 1
C. 5x – 5
D. 5x + 15
E. 10x – 15
Pembahasan :
BU : teorema sisa ax + b
ó x2 + x – 6 = (x + 3)(x – 2)
ó x + 3 =
0
ó x
= – 3
ó f1(x)
= ax + b
ó f1(–
3) = – 3a + b
ó – 10
= – 3a + b …….. (1)
ó x – 2
= 0
ó x = 2
ó f2(x)
= ax + b
ó f2(2)
= 2a + b
ó
5 = 2a + b ……. (2)
Selanjutnya persamaan (1) dan (2)
Maka nilai b dapat dihitung,
ó 2a + b = 5
ó 2(3) + b = 5
ó 6 + b = 5
ó b = 5
– 6
ó b = –
1
Sisanya, 3x – 1
Kunci : B