LARUTAN ASAM – BASA
Kompetensi Dasar :
·
Menjelaskan konsep
asam dan basa serta kekuatannya dan
kesetimbangan pengionannya dalam larutan.
· Menganalisis trayek perubahan pH beberapa indikator
yang diekstrak dari bahan alam melalui percobaan.
Nama Sekolah :
Tahun Pelajaran :
Semester :
Kelas :
XI – MIPA
Bahan Ajar :
Larutan Asam – Basa
Hari/tanggal :
Pertemuan :
ke - …
Daftar Isi :
1.
Perkembangan Teori
Asam – Basa
1.1. Teori Asam – Basa
Arrhenius
1.2. Teori Asam – Basa
Bronsted – Lowry
1.3. Teori Asam – Basa
Lewis
2.
Indikator Asam dan
Basa
3.
Kekuatan Asam dan
Basa
3.1. Asam Kuat
3.2. Asam Lemah
3.3. Basa Kuat
3.4. Basa Lemah
4.
Derajat Disosiasi dan
pH Asam – Basa
4.1. Derajat Disosiasi (⍺ )
4.2. pH
Pertemuan ke – 1
(satu)
1.
Perkembangan Teori
Asam – Basa
1.1. Teori Asam – Basa Arrhenius
Arrhenius mengemukakan
teori mengenai asam dan basa sebagai berikut.
· Asam zat yang jika dilarutkan dalam air menghasilkan
ion H+.
· Basa zat yang jika dilarutkan dalam air akan
menghasilkan ion OH - .
1.2. Teori Asam – Basa Bronsted – Lowry
Teori
asam dan basa yang dikemukakan menurut Brosted – Lowry sebagai berikut.
· Asam adalah suatu zat yang dapat memberikan proton
(donor ion H+).
· Basa adalah suatu zat yang dapat menerima proton
(akseptor ion H+) dan akan
membentuk asam konjugasi.
Kelebihan
a. Menjelaskan sifat
asam – basa zat pada pelarut dan
larutan selain air, bahkan tanpa pelarut.
b. Menjelaskan sifat
asam – basa kation dan anion.
c. Menjelaskan zat yang
bersifat amfoter/amfiprotik
(dapat berupa asam atau basa)
Kelemahan
Kelemahan
teori asam – basa Bronsted – Lowry adalah tidak dapat menjelaskan sifat asam –
basa yang tidak melibatkan transfer proton.
1.3. Teori Asam – Basa Lewis
Lewis
mengemukakan teori Asam – Basa sebagai berikut.
· Asam adalah akseptor
(penerima) pasangan elektron.
· Basa adalah donor
(pemberi) pasangan elektron.
Kelebihan
a. Menjelaskan sifat asam – basa yang tidak melibatkan
transfer proton.
b. Menjelaskan sifat
asam – basa oksida asam dan
oksida basa.
c. Menjelaskan sifat
asam – basa senyawa yang memiliki
pasangan elektron bebas.
d. Menjelaskan sifat
asam – basa senyawa organik,
seperti protein dan DNA.
Kelemahan
a. Hanya dapat
menjelaskan sifat asam – basa zat atau ion
yang mencapai kaidah oktet.
b. Hanya dapat
menjelaskan sifat asam – basa senyawa
kovalen.
2.
Indikator Asam dan
Basa
Indikator
Asam dan Basa adalah zat yang digunakan untuk mengindentifikasi sifat asam –
basa suatu larutan atau zat. Indikator asam – basa yang dapat digunakan adalah
sebagai berikut :
a. Mengalami perubahan
warna yang jelas ketika
ditetesi asam atau basa.
b. Indikator bahan alam
berupa ekstrak warna dari bunga
berwarna terang atau menyala.
3.
Kekuatan Asam dan
Basa
3.1. Asam Kuat
Asam kuat terionisasi
sempurna dalam air (⍺ = 1). Jumlah mol zat
yang terionisasi sama dengan jumlah mol mula – mula.
[H+] =
konsentrasi asam kuat x valensi asam kuat
Asam lemah
terionisasi sebagian dalam air (⍺ < 1). Hanya sebagian asam lemah membentuk
ion. Ionisasi asam lemah merupakan
reaksi kesetimbangan.
Catatan,
Tetapan kesetimbangan
air Kw pada suhu 250C adalah 10 – 14.
Kw = [H+][OH - ]
Keterangan :
[H+] =
ionisasi asam lemah
Ma = konsentrasi
asam lemah
Ka =
tetapan asam lemah
3.3. Basa Kuat
Basa kuat terionisasi
sempurna dalam air (⍺ = 1). Jumlah mol zat
yang terionisasi sama dengan jumlah mol zat mula – mula.
Keterangan :
[OH -] = ionisasi basa
Mb = konsentrasi
basa
b = valensi basa kuat
3.4. Basa Lemah
Basa lemah
terionisasi sebagian dalam air (⍺ < 1). Hanya sebagian basa lemah yang
membentuk ion.
Keterangan
[OH -] =
ionisasi basa lemah
Mb =
konsentrasi basa lemah
Kb =
tetapan basa lemah
Nilai ⍺ untuk asam lemah
Nilai ⍺ untuk basa lemah
4.
Derajat Disosiasi dan
pH Asam – Basa
4.1. Derajat Disosiasi (⍺)
Derajat
disosiasi menunjukkan banyaknya ion H + dan OH – yang dihasilkan
dibandingkan dengan senyawa dalam larutannya. Nilai derajat disosiasi antara 0
dan 1.
4.2. pH
Angka
pH suatu larutan menyatakan tingkat atau derajat keasaman larutan :
pH
= - log [H+]
pada
larutan basa yang mengandung ion OH – berlaku :
pOH
= - log [OH - ]
Hubungan
pH dan pOH dilihat dari nilai pKw = 14, maka :
pH
+ pOH = 14
Contoh : 1
Hitunglah
konsentrasi ion H+ dan ion OH – berikut.
a. Larutan HCl 0,1 M
b. 100 mL larutan Mg(OH)2
5 x 10 – 5 M
c. Larutan HF 0,1M Ka
= 4 x 10 – 7.
d. Larutan NH4OH
0,1M Kb = 10 – 7 .
Pembahasan :
Bagian a
HCl
⟶ H+ + Cl -
ó
[H+] = Ma x a
ó
[H+] = 0,1 x 1
ó
[H+] = 0,1 M
Bagian b
Mg(OH)2
⟶ Mg2+ +
2OH -
ó
[OH-] = Mb x b
ó
[OH-] = 5.10 – 5 x
2
ó
[OH-] = 10 – 4 M
Bagian c
HF
⟶ H+ + F
–
Bagian d
Contoh : 2
Hitunglah
pH larutan berikut
a. Larutan Ba(OH)2
0,005 M
b. Larutan CH3COOH
1,0 M (Ka = 10 – 6)
Pembahasan
Bagian a
Ba(OH)2
⟶ Ba2+ + 2OH –
ó
[OH-] = b x Mb
ó
[OH-] = 2 x 0,005
ó
[OH-] = 0,01
ó
[OH-] = 10 – 2
Maka
nilai pOH dapat dihitung
ó
pOH = - log [OH -]
ó
pOH = - log 10 – 2
ó
pOH = 2
Akhirnya
nilai pH dapat dihitung.
ó
pH = 14 – pOH
ó
pH = 14 – 2
ó
pH = 12
Bagian b
CH3COOH
⟶ CH3COO
- + H+
Maka
nilai pH
ó
pH = - log [H+]
ó
pH = - log 10 – 3
ó
pH = 3



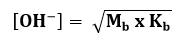









Komentar
Posting Komentar
Silahkan Berkomentar dengan Bijak sesuai dengan semangat kemajuan yang membangun Blog ini dan Jangan keluar dari topik