1. Sel listrik
Sejarah penemuan sel Listrik
Pada tahun 1780, ahli anatomi Italia Luigi Galvani.Secara tidak sengaja
melihat kaki kodok yang sudah mati bisa terkejut saat pisau bedahnya
menyentuh syaraf kaki kodok. Ia berpendapat bahwa efek kejutan
ini berkaitan dengan listrik yang dihasilkan pada syaraf otot kaki kodok.
Alessandro Volta (Italia), tidak sependapat dengan Galvani.
Menurut Volta, kejutan listrik pada kaki kodok mati sungguh disebabkan
oleh dua logam yang berbeda jenis. Untuk menguji pendapatnya ia
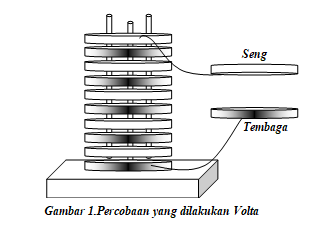
membuat sebuah tumpukkan yang terdiri dari pasangan cakram seng
dengan cakram tembaga, yang pada bagian tengahnya diberi cakram
papan direndam garam. Ketika ia menghubungkan cakram
tembaga paling atas dengan cakram seng paling bawah melalui dua kabel,
dan ia menyentuh sambungan kedua kabel dengan ujung lidahnya.
Ia mendapatkan kejutan listrik (kesetrum).
Gambar percobaan Volta:
Macam – macam sel listrik Sel sederhana
Dari percobaan Volta, dapat dibuat sel sederhana yang memiliki prinsip
sel sederhana terdiri dari dua buah elektroda. Elektroda positip disebut
anoda dan elektroda negatip disebut Katoda dan zat yang berfungsi
sebagai elektrolit. Elektrolit melalui reaksi kimia menghasilkan
bedapotensial pada kedua elektroda (kutub).
Larutan elektrolit : Larutan yang dapat menghantarkan arus listrik, akibat reaksi kimia yang
menghasilkan ion – ion negatip dan ion – ion positip. Yang termasuk zat
elektrolit a. l :
Cara kerja sel sederhana :
Ketika kutub – kutub kedua plat dihubungkan dengan kawat terjadi
reaksi kimia. Seng dari plat seng melarut dalam asam, sehingga
ion – ion seng positip meninggalkan elektron – elektron pada plat seng,
sehingga pelat seng menjadi bermuatan negatip.
Elektron – elektron dari pelat seng bergerak melalui kawat penghubung menuju ke pelat tembaga.
Pada pelat tembaga ini, elektron – elektron dapat ditangkap oleh ion – ion positip hidrogen yang terdapat dalam larutan asam, sehingga ion hidrogen berubah menjadi gas hidrogen.
Jika pelat tembaga dan pelat seng dihubungkan dengan kawat tembaga
melalui sebuah lampu pijar kecil, maka lampu pijar akan menyala.
Lampu pijar hanya berpijar sebentar kemudian meredup dan padam.
Karena gelembung – gelembung menghalangi pelat tembaga untuk
kontak dengan baik dengan larutan asam, dan tentu saja akan
menghentikan reaksi kimia. Peristiwa mengumpulnya gelembung – gelembung gas hidrogen di sekitar pelat tembaga disebut polarisasi.
Sel kering
Sel ini disebut sel kering (dry cell) karena sel ini tidak mengandung
cairan dan dapat digunakan kapan saja. Sel kering yang sering
ditemui adalah sel kering sel karbon – seng.
Elektroda positipnya (anoda) adalah sebuah batang karbon, dikelilingi oleh
campuran mangan dioksida (MnO2) dan serbuk karbon sebagai
depolarisator (zat pelindung elektrolit). Bungkus luar terbuat dari seng,
sebagai elektroda negatip (katoda). Diantara depolarisator dan bungkus
seng terdapat pasta amonium klorida (NH4Cl) sebagai elektrolit.
Bedapotensial antara kutub – kutub sebuah sel kering umumnya 1,5 volt.
Muatan sel kering habis jika karbonnya atau elektrolitnya habis.
Sel alkalin
Pusat sel terbuat dari serbuk seng sebagai elektroda positip dan pasta
terbuat dari potasium hidroksida dan seng oksida sebagai elektrolit.
Elektroda positip dikitari oleh pelet yang mengandung mangan dioksida
sebagai elektroda negatip.
Sel dibagi menjadi dua bagian, yaitu :
Sel Primer = sel yang tidak dapat dimuati berulang kali.
Contoh :
- sel sederhana,
- sel kering karbon – seng,
- sel alkalin
Sel Sekunder = sel yang dapat dimuati berulang kali karena reaksi
kimianya dapat dibalikan.
Contoh :
- sel timbal – asam (akumulator)
- sel Nicad (Nikel – Cadmium)
- sel Natrium – Sulfida
- fuel cell
- sel surya
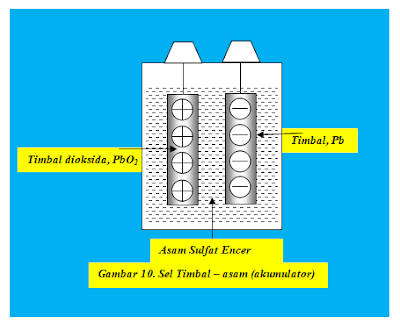
Sel Timbal – Asam (Akumulator)
Sel timbal – asam atau yang lebih
sering dikenal dengan nama Akumultor
(termasuk jenis sel sederhana).
Sebelum dipakaiAgar akumulator dapat bekerja dengan baik, maka pertama kali ia harus dimuati oleh sumber arus listrik lain. Tatkala baterai dimuati, oksida timbal terbentuk pada salah satu pelat timbal. Pelat timbal berlapis dioksida menjadi elektroda positip (anoda) dan pelat timbal biasa menjadi elektroda negatip (katoda).
Saat dipakai
Baik pelat timbal berlapis timbal oksida maupun pelat biasa, keduanya secara perlahan berubah menjadi timbal sulfat karena bereaksi dengan larutan asam sulfat encer. Dalam reaksi ini dilepaskan elektron – elektron, sehingga jika kedua pelat dihubungkan dengan jalur konduksi maka arus listrik mengalir di luar larutan dari kutub positip ke kutub negatip. Reaksi kimia yang terjadi tentu saja makin mengencerkan asam sulfat sehingga massa jenisnya berkurang. Pada nilai massa jenis tertentu, akumulator tidak dapat menghasilkan muatan listrik (akumulator padam)
Saat dicaharge ulang
Agar akumulator berfungsi kembali, ia harus dimuati ulang oleh sumber arus searah dc lain. Untuk itu kutub (+) akumulator dihubungkan ke kutub (+) sumber arus pengisi, dan kutub negatip (–) akumulator dihubungkan dengan sumber (–) sumber arus pengisi. Akibatnya elektron – elektron akumulator ditekan kembali melalui sel. Ini membalikkan reaksi kimia sehingga kedua plat timbal sulfat berubah. Pada pelat positip, timbal sulfat berubah menjadi pelat timbal berlapis timbal dioksida, dan plat negatip timbal sulfat berubah menjadi timbal biasa.
Ada empat hal yang perlu diperhatikan selama proses
pemuatan ulang sebuah aki :
- Baterai pengisi (sumber dc) yang digunakan harus memiliki bedapotensial yang lebih besar daripada bedapotensial aki
- Lebih efektif untuk memuati ulang dengan arus kecil dalam selang waktu yang lama daripada dengan arus besar dalam selang waktu yang singkat. Rheostat (resistor variabel) digunakan untuk mengatur nilai arus ini.
- Selama proses pengisian, konsentrasi asam sulfat bertambah dan tinggi permukaan cairan turun. Pada ketinggian tertentu, cairan harus ditambah dengan air suling.
- Kapasitas aki diukur dalam satuan ampere-jam (ampere – hour dan disingkat AH). Kapasitas aki 40 AH berarti dapat bekerja selama 40 jam pada arus 1 ampere atau selama 20 jam pada arus 2A, dan seterusnya, sebelum aki perlu dimuati ulang.
Begitu akumulator bekerja menghasilkan muatan listrik, massa jenis larutan asam sulfat berkurang karena asam sulfatnya bereaksi dengan timbal dan timbal dioksida. Makin kecil nilai massa jenis larutan asam sulfat berarti makin sedikit muatan listrik yang diberikan akumulator.
Jika massa jenis relatif asam sulfat :
1,25 = muatan aki penuh
1,00 = muatan aki kosong
Alat untuk memeriksa muatan aki disebut Hidrometer.
Sel Nicad
Ini adalah sel kering kecil yang dapat dimuati ulang. Sebagai ganti seng dan karbon sebagai elektroda. Sel ini menggunakan nikel hidroksida untuk elektroda negatip dan cadmium sebagai bungkus luar sebagai elektroda positip. Dengan demikian nama Nicad berasal dari Nikel dan Cadmium. Diantara kedua elektroda terdapat pasta dari bahan potasium hidroksida (sebagai elektrolit). Bedapotensial yang dihasilkan oleh sebuah sel Nicad adalah sekitar 1,2 volt.
Sel – sel lain (pengayaan)
- Sel Natrium – Sulfida
- Fuell – Cell
- Sel Surya



Tidak ada komentar:
Posting Komentar
Silahkan Berkomentar dengan Bijak sesuai dengan semangat kemajuan yang membangun Blog ini dan Jangan keluar dari topik